I. LE STYRENE
1) La molécule et ses propriétés
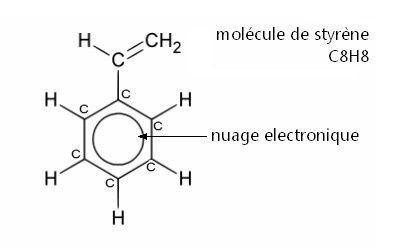
| Formule brute | C8H8 |
| Synonymes | Vinylbenzène, styrol, phényléthylène, ethènylbenzène… |
| Aspect | Liquide huileux incolore ou jaunâtre. |
| Masse molaire | 104 g.mol-1 |
| Point de fusion | -30.6°C |
| Point d'ébullition | 145°C |
| Densité (eau=1) | 0.9 à 20°C (flotte quasiment) |
| Solubilité | Insoluble dans l’eau. Soluble dans l’acétone, l’éther, le disulfure de carbone et les alcools. |
| Risques pour la santé |
Inhalation → vertige, nausée, faiblesse, somnolence.. Contact avec la peau → rougeur Contact avec les yeux → rougeur, douleur
|
2) Polymérisation
a → Définition générale
Polymérisation :
Formation de macromolécules à partir de molécules identiques ou différentes appelées monomères qui pour former un polymère s’unissent les unes aux autres par des liaisons covalentes. Durant la polymérisation, la double liaison de la molécule de carbone (C) est ouverte pour unir les molécules et ainsi former la macromolécule.
b → Quel type de polymérisation ?
Le polystyrène se fabrique à partir du styrène. C’est un thermoplastique rigide qui se moule à chaud et garde sa forme à froid.
La polymérisation du styrène est une polyaddition qui consiste à additionner les unes à la suite des autres un très grand nombre de molécules identiques, des molécules de styrène (C8H8).
Dans le cas du styrène, les monomères comportent toujours une double liaison carbone (C=C) et comme nous l’avons expliqué précédemment, lors de la polymérisation, cette liaison se casse pour permettre aux autres monomères de s’unir comme on le voit sur le schéma ci-dessous.

(Nous avons réalisé un modèle moléculaire de cette polymérisation, il sera présenté lors de l'oral)
Plus précisément, cette polymérisation est appelée radicalaire.
Dans ce schéma sont regroupés tout les procédés, les voix et les types de polymérisation.

On peut polymériser le styrène selon différents procédés.
En masse : cela consiste à polymériser le monomère à l’état liquide ou gazeux, avec généralement un catalyseur. Mais la masse réactionnelle devient très visqueuse au fur et à mesure de l’avancement et il est difficile de contrôler la température par une agitation efficace. De plus pour le styrène cela provoque un effet indésirable. Ce procédé n’est donc pas très souvent utilisé pour la polymérisation du styrène.
Pour des raisons économiques, on polymérise le styrène en émulsion ou en solution avec des solvants non polluants et des échauffements faibles.
En émulsion : On a un contrôle aisé de la température et de la viscosité. L’avancement se fait rapidement, avec une grande efficacité et produit une masse élevée de polymère. Mais on a tout de même une séparation difficile entre le solvant et le polymère par le tensioactif.

En solution : la polymérisation s’effectue en présence d’un solvant dans lequel se forme le polymère. On a un bon contrôle de la température mais le solvant est coûteux, la masse moléculaire limité et le polymère est difficile à sécher après sa synthèse.
3) Les états
L’état solide se présente sous deux aspects :
L’état cristallin : état ordonné ; sous l’influence de forces internes, les chaînes moléculaires se rangent entre elles de façon ordonnée sur de petites longueurs. Le principal trait distinctif de cet aspect est l’existence d’une température de fusion précise (à pression donnée) et strictement constante durant toute la durée du processus.
L’état amorphe : état désordonné ; les molécules sont très proches les unes de autres, la réaction se développe de façon anarchique ce qui donne un polymère ramifié donc moins cristallin. Une analyse au rayon X a confirmé un arrangement désordonné des atomes analogues dans les corps amorphes et liquides. Un corps amorphe ressemble donc plus à un liquide figé qu’a un cristal raté.
Pour donner un exemple imagé on peut comparer l'état amorphe à un tiroirs de chaussettes en fouillis tandis que l'état cristallin serait assimilé à un tiroirs de chaussettes bien ordonnées.
Lexique
→ Tensioactifs : les tensioactifs ou agents de surface sont des composé qui modifient la tension superficielle
entre 2 surfaces.
Les composés tensioactifs sont des molécules amphilies, c'est à dire qu'elles présentent
2 parties de polarité différente : l'une lipophile (miscible dans l'huile) et apolaire, l'autre
hydrophile (miscible dans l'eau) et polaire.
→ Tension supercielle/ énergie de surface : tension qui existe à la surface de séparation de 2 milieux.
→ Micelles : particules colloïdales en suspension dans un milieu généralement formées par de groupements
de molécules semblables présentant une extrémité hydrophile et une extrèmité hydrophobe.
→ Colloïdales : se dit des solides ou des solutions qui contiennent un corps dispersé sous forme de micelle.

